2023.04.24

辅助性T(T helper,Th)淋巴细胞亚群是机体适应性免疫系统的关键组分,包括了在分子特征、产细胞因子、效应功能及组织分布上有所差异的一群细胞[1]。Th亚群细胞由胸腺CD4+Naïve T细胞在不同强度抗原刺激因素、不同内细胞因子及转录信号等诱导作用下进一步分化而来,并根据分化过程中激活的转录因子、表达的不同细胞因子和归巢受体而定义。目前研究较多的Th亚群主要是Th1、Th2、Th17、Treg、Th22、Th9 [2,3]。Th细胞亚群是机体免疫系统重要的调节器,在适应性免疫调节反应中,它们既参与细胞毒性细胞免疫应答调节,又介导B细胞依赖性抗体的产生,还能与固有免疫系统组分相互作用。研究显示,与树突状细胞(dendritic cell,DC)接触进而产生的细胞因子决定了Th细胞亚群的分化方向[4]。Th细胞亚群是宿主免疫防御的关键因素,也是免疫介导疾病的主要驱动分子,其通过产生一系列细胞因子,参与感染、炎症、过敏性疾病、自身免疫性疾病以及肿瘤等疾病的发生发展[2,5,6]。
细胞因子决定了Th亚群的分化方向,而分化的亚群细胞通过产生不同的细胞因子参与疾病进展;各亚群之间保持平衡维持了机体健康状态,失衡则将导致疾病状态[6]。
本文将就Th亚群功能与临床疾病的关系进行综述,以期了解Th细胞亚群的临床价值。
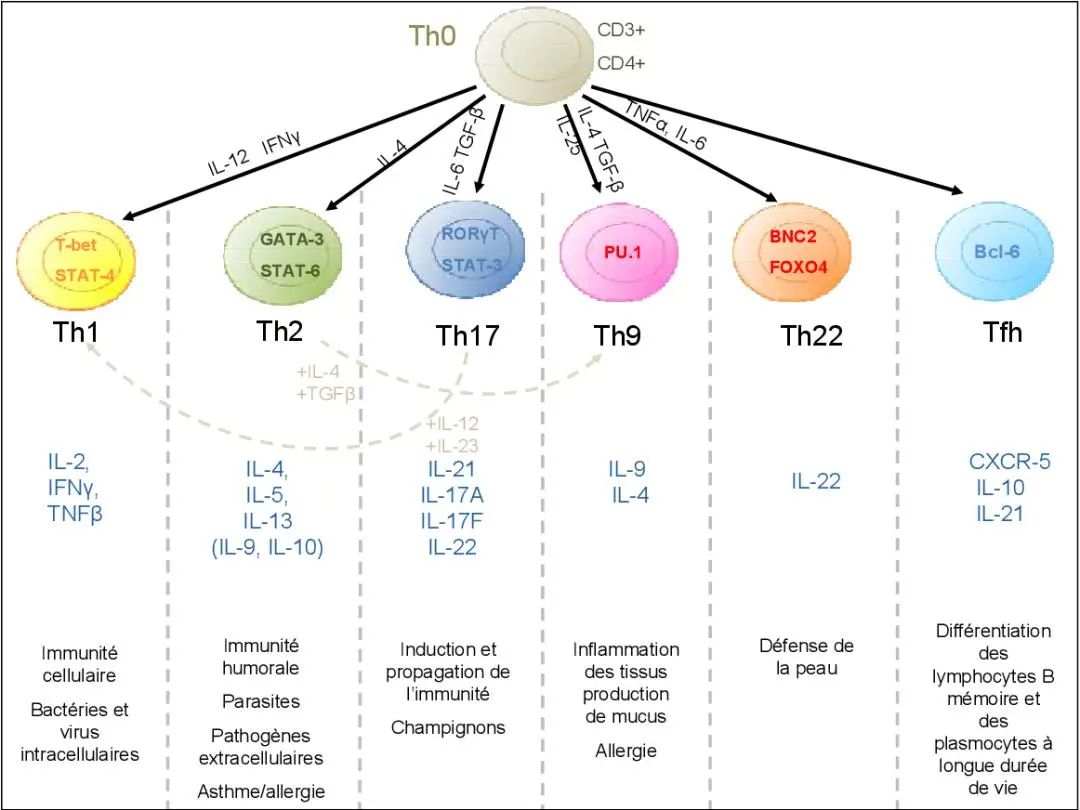
Th1、Th2功能细胞亚群是最早被描述的辅助性T细胞亚群,在过去的数十年里得到了较为充分的研究。Th1主要参与细胞免疫调节,通过产生高水平的IFN-γ,参与吞噬细胞的活化,通过调理吞噬作用以及补体固定抗体,在机体抗病毒或胞内病原微生物感染以及消除肿瘤细胞中发挥用。此外Th1也介导机体炎症反应和迟发型超敏反应,与一些自身免疫疾病,如自身免疫性脑炎和机体慢性炎症反应,如胶原相关关节炎和炎症性肠病有关[9]。Th2主要介导体液免疫调节,通过促进抗体的产生对抗胞外病原体(如寄生虫感染),并在过敏反应的发生发展以及异种移植和妊娠过程中的免疫耐受方面发挥作用。Th1主要通过产生IFN-γ发挥其生理功能,Th2则主要产生IL-4发挥效应。生理情况下二者相对稳定,受到相互抑制和自分泌的转录和信号因子的调节。病理情况下稳态打破,表现为某亚型优势参与疾病发展。
在病毒感染性疾病中,HBV感染所致慢性肝炎、活动性肝炎后肝硬化及慢性重症肝炎等情况下常表现为Th1亚群优势[10],而HCV隐匿性感染和HIV感染后AIDS进展后期则以Th2应答为主[11,12]。在细菌性脓毒血症患者中,表现为Th2优势应答的患者临床进展更快、死亡率更高[13]。在机体抗肿瘤免疫方面,适应性免疫细胞中的Th细胞通过产生IFN-γ直接杀伤或招募激活NK或巨噬细胞等间接方式对抗肿瘤细胞,以Th1应答为主的患者预后更好[14]。
Th17主要诱导机体的炎症反应,参与自身免疫性疾病的发生发展。Treg则主要发挥免疫抑制作用,在机体免疫自稳过程中意义重大,机体Treg不足将更容易发生自身免疫性疾病。正常情况下,Th17/Treg保持着动态平衡,在机体免疫防御、炎症反应和免疫耐受等方面发挥效应。
在机体细菌和真菌感染后,Th17能通过直接产生GM-CSF招募和激活中性粒细胞和单核细胞,或间接诱导患者CSF和CXCL8发挥抗感染作用,而在特应性皮炎、克罗恩病、牛皮癣和多发硬化症的患者中发现升高的Th17,均提示其参与了自身免疫性疾病和炎症反应[7]。研究对Th17在肿瘤免疫方面的作用结论不一,患者的转归与肿瘤类型有关,有可能成为未来肿瘤免疫治疗的靶点[15]。而Treg则是明确的肿瘤免疫障碍成分,是肿瘤细胞免疫逃逸的重要帮凶。
在肿瘤发生早期,Treg通过直接抑制实体瘤局部的免疫效应细胞帮助肿瘤进展;在肿瘤发生后期,Treg通过自身系统上调,抑制机体对转移瘤的免疫效应,促进肿瘤转移。因此,减少Treg细胞和控制其功能以增加抗肿瘤免疫应答是肿瘤免疫治疗领域潜在的靶点[16]。机体Th17/Treg相互作用调节,维持机体免疫稳态,在疾病状态下二者调节失衡,疾病则表现出进展状态。如在肿瘤患者中表现出Treg优势的患者更易复发和转移[17]。在细菌性脓毒血症患者中,外周血Treg细胞升高、Th17减少者更易进展为创伤性休克[18]。
Th22主要通过产生IL-22发挥生物学效应。IL-22是IL-10家族成员,通过作用于上皮细胞、胰腺细胞、肝细胞和某些类型的成纤维细胞,介导宿主防御侵袭性病原体。在炎症性肠病、哮喘、系统性硬化症和类风湿性关节炎等自身免疫病或过敏性疾病中均可见IL-22的升高,但效应不一,既可能抑制炎症反应,也可能促进疾病进展,这取决于内环境和疾病阶段[19,20]。此外有研究报道在肿瘤患者中也观察到Th22和其效应分子IL-22的变化,提出其可能是未来肿瘤免疫治疗的潜在靶点[21]。
Th9通过IL-9主要参与自身免疫性疾病和过敏性疾病的发生发展[22]。IL-9在免疫系统中具有许多重要的功能,它促进T细胞和肥大细胞的存活和增殖,刺激多种细胞因子的产生,并调节B细胞的反应,其在抗肿瘤中也有一定作用[23,24]。Th9细胞也能产生IL-10和IL-21,但其功能尚待阐明。
生理状态下,机体内的Th细胞亚群保持着动态平衡,维持正常免疫调节功能。当感染、炎症、肿瘤等疾病发生时,Th亚群受到抗原刺激,在细胞因子作用下亚群分化平衡被打破,免疫调节功能失调,疾病进展;经过治疗,亚群平衡恢复,疾病好转。积极开展淋巴细胞亚群在不同疾病状态下的深入研究,对于深入认识疾病发展规律以及新治疗策略的探索极具意义。
[1] Read K A,Powell M D,Sreekumar B K,et al.In vitro differentiation of effector CD4+T helper cell subsets[J].Methods Mol Biol,2019,1960:75-84.
[2] Zhu J.T Helper cell differentiation,heterogeneity,and plasticity[J].Cold Spring Harb Perspect Biol,2018,10(10):a030338.
[3]Morel P A.Differential T-cell receptor signals for Thelper cell programming[J].Immunology,2018,155(1):63-71.
[4]Schmitt N,Ueno H.Regulation of human helper T cell subset differentiation by cytokines[J].Curr Opin Immunol,2015,34:130-136.
[5]Raphael I,Nalawade S,Eagar T N,et al.T cell subsets and their signature cytokines in autoimmune and inflammatory diseases[J].Cytokine,2015,74(1):5-17.
[6]Ivanova E A,Orekhov A N.T helper lymphocyte subsets and plasticity in autoimmunity and cancer:an overview[J].Biomed Res Int,2015,2015:327470.
[7] Zhang Y,Zhang Y,Gu W,et al.TH1/TH2cell differentiation and molecular signals[J].Adv Exp Med Biol,2014,841:15-44.
[8]Girolomoni G,Strohal R,Puig L,et al.The role of IL-23and the IL-23/TH 17immune axis in the pathogenesis and treatment of psoriasis[J].J Eur Acad Dermatol Venereol,2017,31(10):1616-1626.
[9]Hirahara K,Poholek A,Vahedi G,et al.Mechanisms underlying helper T-cell plasticity:implications for immune-mediated disease[J].J Allergy Clin Immunol,2013,131(5):1276-1287.
[10]Li M H,Zhang D,Zhang L,et al.Ratios of T-helper 2cells to T-helper 1cells and cytokine levels in patients with hepatitis B[J].Chin Med J (Engl),2017,130(15):1810-1815.
[11]Mousa N,Eldars W,Eldegla H,et al.Cytokine profiles and hepatic injury in occult hepatitis C versus chronic hepatitis C virus infection[J].Int J Immunopathol Pharmacol,2014,27(1):87-96.
[12] Gorenec L,Zidovec Lepej S,Grgic I,et al.The comparison of Th1,Th2,Th9,Th17and Th22cytokine profiles in acute and chronic HIV-1infection[J].Microb Pathog,2016,97:125-130
[13] Gupta D L,Bhoi S,Mohan T,et al.Coexistence of Th1/Th2and Th17/Treg imbalances in patients with post traumatic sepsis[J].Cytokine,2016,88:214-221.
[14]Vesely M D,Kershaw M H,Schreiber R D,et al.Natural innate and adaptive immunity to cancer[J].Annu Rev Immunol,2011,29:235-271.
[15] Chang S H.T helper 17(Th17)cells and interleukin-17(IL-17)in cancer[J].Arch Pharm Res,2019,42(7):549-559.
[16] Ohue Y,Nishikawa H.Regulatory T (Treg)cells in cancer:can treg cells be a new therapeutic target[J].Cancer Sci,2019,110(7):2080-2089.
[17] Lanca T,Silva-Santos B.The split nature of tumor-infltrating leukocytes:implications for cancer surveillance and immunotherapy[J].Oncol Immunol,2012,1(5):717-725.
[18] Tang M S,Bowcutt R,Leung J M,et al.Integrated analysis of biopsies from inflammatory bowel disease patients identifies SAA1as a link between mucosal microbes with TH17and TH22cells[J].Inflamm Bowel Dis,2017,23(9):1544-1554.
[19]Tamasauskiene L,Sitkauskiene B.Role of Th22and IL-22in pathogenesis of allergic airway diseases:proinflammatory or anti-inflammatory effect[J].Pediatr Neonatol,2018,59(4):339-344.
[20] Jia L,Wu C.The biology and functions of Th22cells[J].Adva Exp Med Biol,2014,841:209-230.
[21] Deng Y,Wang Z,Chang C,et al.Th9cells and IL-9in autoimmune disorders:pathogenesis and therapeutic potentials[J].Hum Immunol,2017,78(2):120-128.
[22] Koch S,Sopel N,Finotto S.Th9and other IL-9-producing cells in allergic asthma[J].Semin Immunopathol,2017,39(1):55-68.
[23] Chauhan S R,Singhal P G,Sharma U,et al.Th9cytokines curb cervical cancer progression and immune evasion[J].Hum Immunol,2019,80(12):1020-1025.
在不同靶点药物开发过程中,需要检测不同Th亚群所介导的不同细胞因子家族分泌水平的变化。细胞因子水平变化是检测不同免疫细胞的活化或者抑制最直接有效的方式。过高的本底释放或过低的细胞因子分泌都会导致实验检测窗口变小,可能导致无法充分验证候选分子的效果。由于不同种族、性别、年龄等个体差异的影响,不同供体来源的PBMC细胞分泌细胞因子水平有可能会有差异。
TPCS®提供细胞因子分泌水平预检测服务,使用PMA+Ionomycin对不同供体来源的PBMC进行刺激,通过流式微球捕获芯片技术(CBA), 检测Th1/Th2/Th17(IL-2, IFN-γ, TNF, IL-6, IL-10, IL-4, IL-17)细胞因子分泌水平,并出具对应检测报告。筛选出以上细胞因子本底释放极低,刺激后多种不同细胞因子释放显著升高的批次,为客户提供更加多样化的选择。
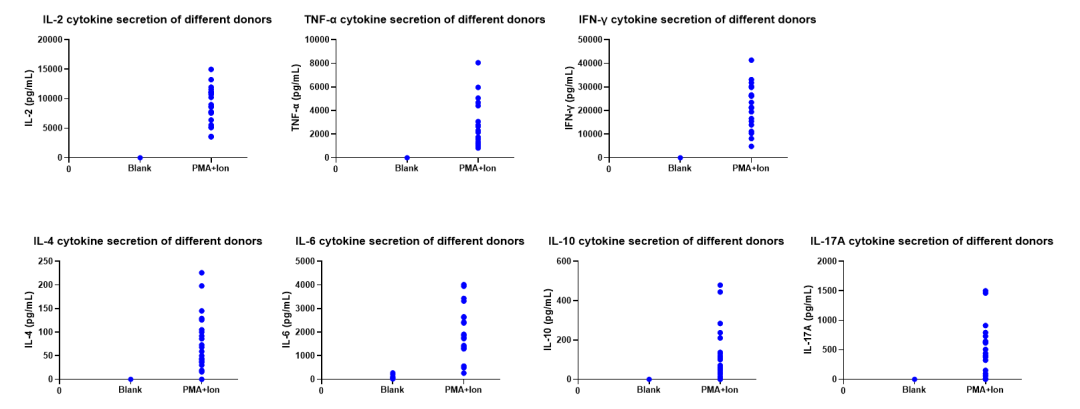
点击上图可查看大图
所有Donor本底各种细胞因子均几乎没有释放,PMA+Ion可以明显刺激PBMC分泌各类细胞因子,且不同Donor分泌水平存在明显差异。
空白组:Blank , 考察静息状态下PBMC细胞因子本底释放水平;
阳性组:PMA+Ionomycin,考察刺激后PBMC细胞因子释放水平;
备注:PMA 和Ionomycin进行处理PBMC足以诱导许多细胞类型活化,产生多种细胞因子。



妙顺生物
咨询热线:021-64169739
咨询邮箱:sales@miles-bio.com