2023.07.10

双特异性抗体(Bispecific antibodies, BsAbs)是通过细胞融合、重组DNA、蛋白质工程等技术制备的人工抗体,可以同时或先后特异性结合两种抗原或同一抗原的两个不同表位,增强免疫应答,提高肿瘤靶向特异性。与单抗相比,BsAbs增加了特异性抗原结合位点,具有靶向性强、特异性高、用药次数少、毒副作用低、靶细胞杀伤能力强等优点。BsAbs的概念是由Nisonoff在50多年前首次提出。随着抗体工程和抗体生物学研究技术的飞速发展,关于BsAbs的概念、技术创新及临床试验增长迅速,如图1所示。
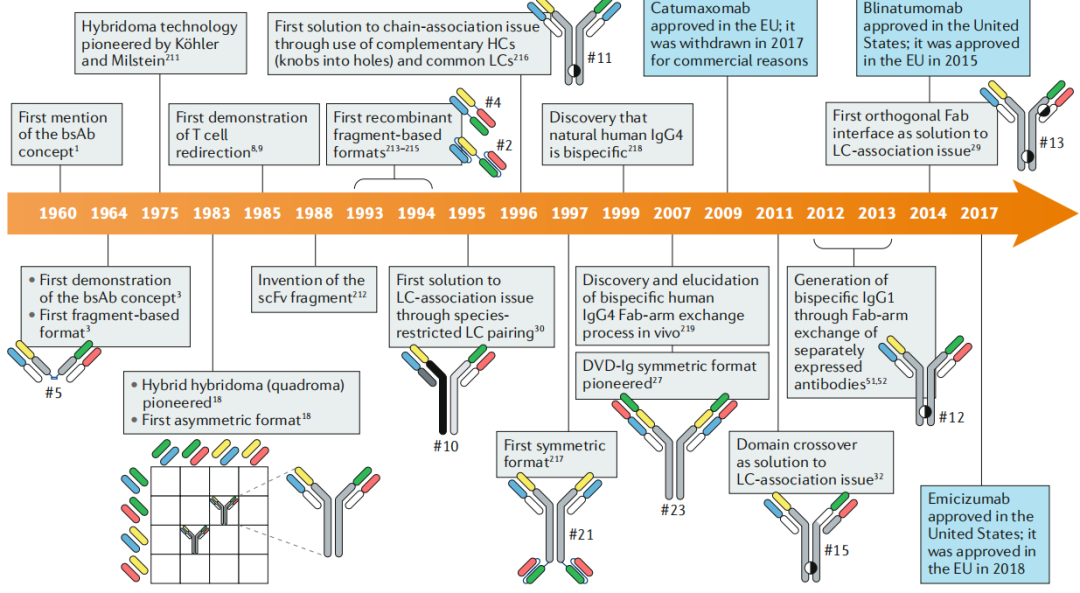
图1:BsAbs发展和技术创新时间轴
BsAbs根据其与IgG的相似程度被分为:(1)包含Fc区和相关效应功能的“IgG样”分子;(2) 缺少Fc区的“非IgG样”分子。IgG样BsAbs类似于常规抗体,尺寸和分子量更大,经历FcRn循环,血清半衰期长,包括:三特异性抗体 (TrAbs)、共同轻链、双可变域免疫球蛋白(DVD-Ig)、CrossMab、Two-in-one IgG、IgG-scFv(单链可变片段)和IgG-sVD(单可变域)等。非IgG样BsAbs形式多样,分子量小,组织渗透性高,但血清半衰期很短(约1-2小时),也称为BsAbs片段,包括双抗体、TandAbs(串联抗体)、scFv-人血清白蛋白(HSA)-scFv、BiTE、双亲和力重新靶向(DART)抗体和Nanobody等。目前已有100多种不同形式的BsAbs,图2展示了常见的几种BsAbs结构形式。
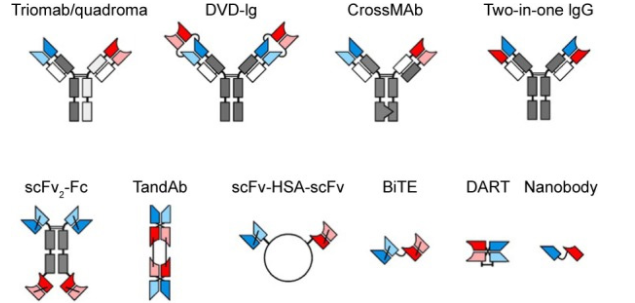
图2:常见的双特异性抗体结构形式
BsAbs的主要作用机制:(1)桥联作用,实现细胞毒性效应细胞的重定向功能。BsAbs的一个抗原结合位点与肿瘤细胞的特异性抗原结合,另一个抗原结合部位桥联并激活效应细胞,如NK细胞、细胞毒性T淋巴细胞等。目前处于研发中的BsAbs,作用机制为重定向并激活表达CD3的细胞毒性T细胞针对性杀伤特定抗原的肿瘤细胞。(2)桥联受体作用,BsAbs靶向同一细胞表面的两个不同受体,同时特异性阻断或增强多条信号通路,从而增强靶向特异性和安全性。此外BsAbs还可通过将受体A和受体B桥联在一起,激活受体下游信号通路。(3)介导蛋白复合物形成作用,BsAbs被用于酶和底物的辅因子模拟物,提高抗体药物偶联物或抗体的活性。例如在血友病治疗中,BsAbs同时桥联结合凝血因子IXa和X,仿真FVIII的生理功能,促进凝血酶的产生。(4)Piggybacking转运,使活性结合domain易位到无法进入的部位,例如转运受血脑屏障保护的中枢神经疾病靶点或在endosomal逃逸中起作用的细菌或病毒抗原,如图3所示。
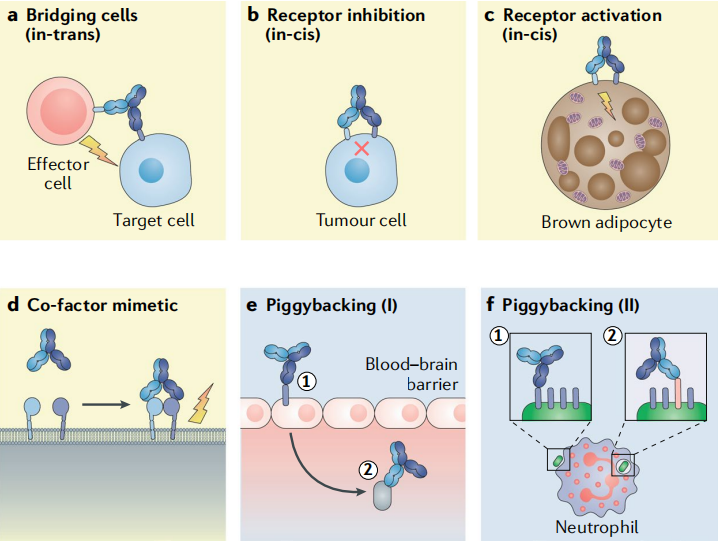
图3: BsAbs的作用机制
目前用于BsAbs开发的药物管线呈指数增长,已有超过250多种BsAbs处于研究和临床阶段,并针对多种类型的癌症。截止到2022年8月,全球已经有8款双抗/融合蛋白类药物上市,图4所示。
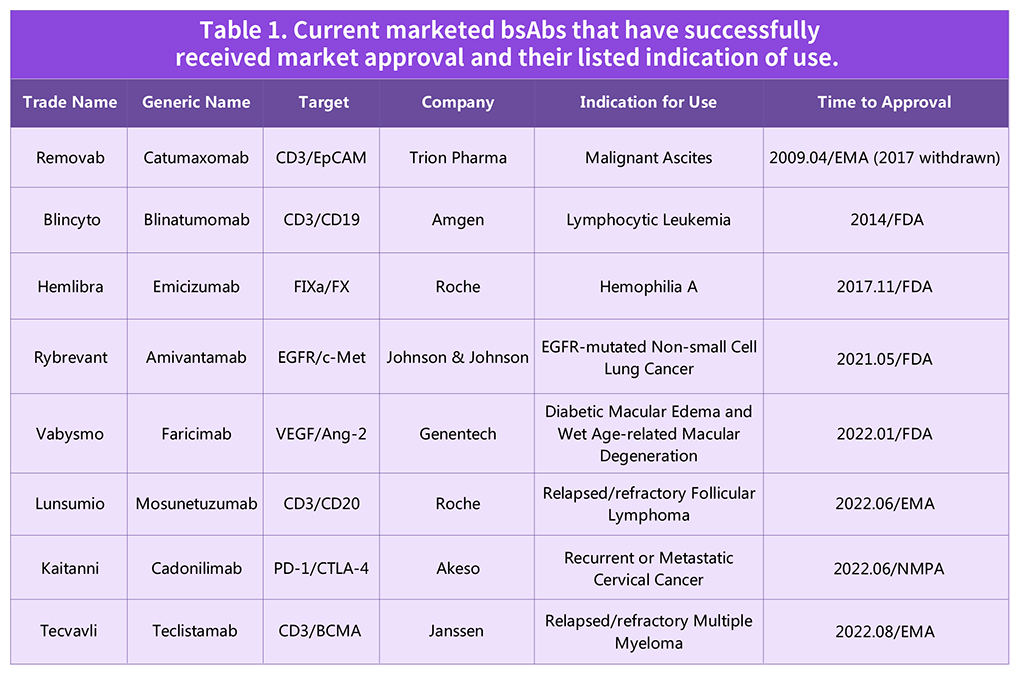
图4: 已成功获批上市BsAbs及其适应症
Catumaxomab 是全球首个商业化的双抗药物,分子量150 kDa,属于TrAbs家族,由2个不同的抗原结合Fab和一个Fc区组成,同时靶向CD3和EpCAM,CD3为T细胞招募靶点,EpCAM全称上皮细胞黏附分子,在肿瘤细胞增殖、分化、迁移以及免疫逃逸等多种生物学功能中发挥重要作用,Fc结构域与其他免疫细胞(如巨噬细胞和NK细胞)的Fc受体结合,通过激活T细胞介导的裂解、细胞吞噬作用、NK细胞介导的细胞毒性(ADCC)和细胞因子介导的细胞毒性杀伤肿瘤细胞,如图5所示。Catumaxomab分别于2006年和2009年被FDA批准用于EpCAM阳性卵巢癌和胃癌的孤儿药,最终由于商业化不利于2017年退市。此外Catumaxomab的设计也存在弊端:Removab是一种大小鼠嵌合双抗,存在人抗鼠抗体反应。而CD3作为一个重要的T细胞靶点,易诱发细胞因子释放综合征(CRS),引起组织损伤,导致微血管病变、心脏衰竭甚至死亡。
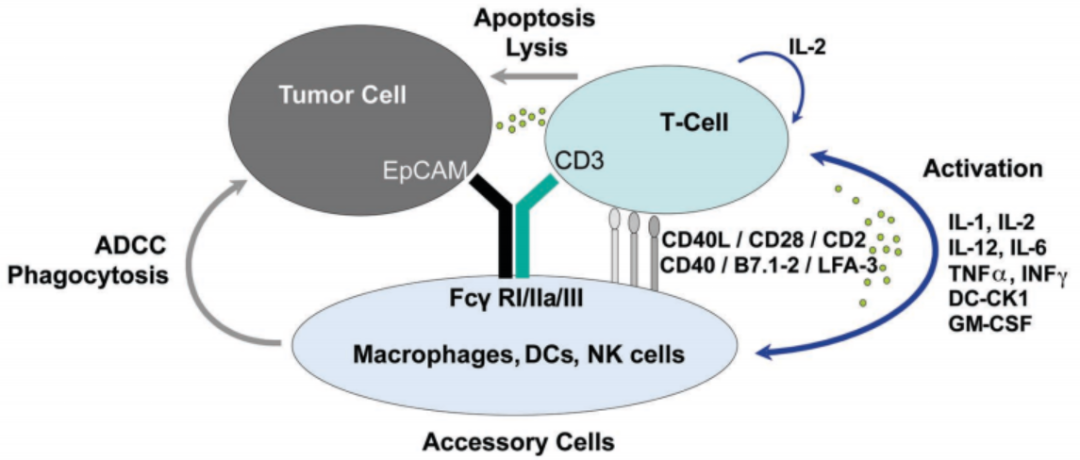
图5:Catumaxomab三功能抗体结构
Blinatumomab是一种55kDa大小,靶向CD19和CD3的双特异性T细胞桥联抗体 (BiTE),抗CD19和抗CD3单链可变结构域(Fv)通过非免疫原性甘氨酸-丝氨酸接头序列连接,编码可变区片段和接头序列的cDNA通过重组DNA技术融合。恶性B淋巴细胞高表达CD19抗原,它与B细胞活化、信号传导及生长调节密切相关,并作为重要标记物被广泛应用于白血病、淋巴瘤及免疫系统疾病的诊断和预后判断,因此是急性淋巴细胞白血病 (ALL)、慢性淋巴细胞白血病(CLL) 和非霍奇金淋巴瘤 (NHL) 中特别好的靶抗原。FDA在2014年加速批准Blinatumomab用于治疗Ph染色体阴性复发或难治性ALL。Blinatumomab将表达CD19 的肿瘤细胞与表达CD3的细胞毒性T细胞桥接起来(图6),增强T细胞对肿瘤细胞的特异性杀伤,但Blinatumomab血清半衰期较短,需要频繁给药。
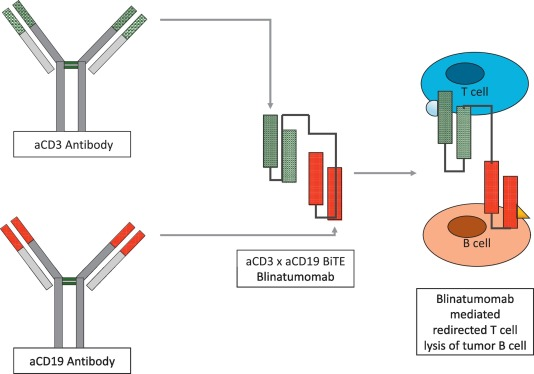
图6:Blinatumomab:结构和作用机制
非癌症适应症的BsAbs首次进入市场是在2017年11月,当时FDA批准了用于治疗A型血友病的emicizumab (凝血因子IXa (FIXa) × FX)。Hemlibra是一款重组人源化的双特异性双抗药物,通过桥接FIXa和FX,促进凝血酶的生成,使FⅧ功能障碍或完全缺乏FⅧ的A型血友病患者的出血部位达到有效止血,如图7所示。Hemlibra作为全球唯一一款治疗A型血友病的药物,2021年销售额达到34.15亿美元,且有逐年增长趋势,临床意义重大。
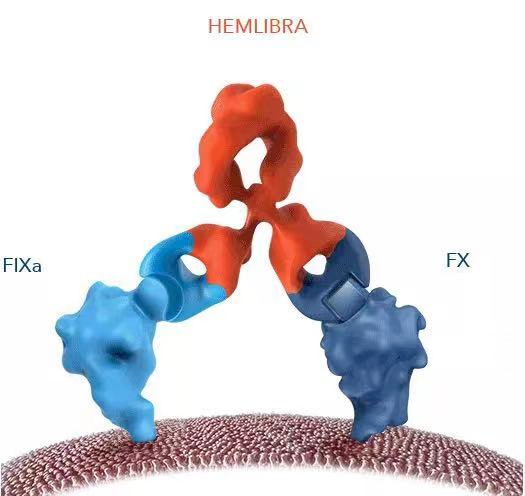
图7:Hemlibra结构
Amivantamab是一种特异性识别EGFR和c-Met受体的双抗药物,通过阻断EGFR和c-Met的下游信号通路抑制肿瘤生长,同时可以通过NK细胞和巨噬细胞介导的ADCC和ADCP作用杀伤肿瘤。Amivantamab对肿瘤的杀伤抑制作用显著优于单抗药物,如图8所示。2021年5月21日FDA批准Rybrevant EGFR/c-Met双抗药物用于治疗铂类化疗治疗失败后的EGFR 20号外显子插入突变导致的转移性非小细胞肺癌(NSCLC)患者,是全球第四款获批上市的双抗药物。cMet是间质表皮转化因子,配体为肝细胞生长因子(HGF),正常情况下HGF/c-Met可介导胚胎发育、细胞增殖、组织损伤修复和神经肌肉形成,并受抑癌基因p53的调控。但突变后的c-Met在肿瘤由上皮细胞向间充质细胞转化中发挥重要作用,是肿瘤细胞侵袭、转移和扩散的重要靶点之一。
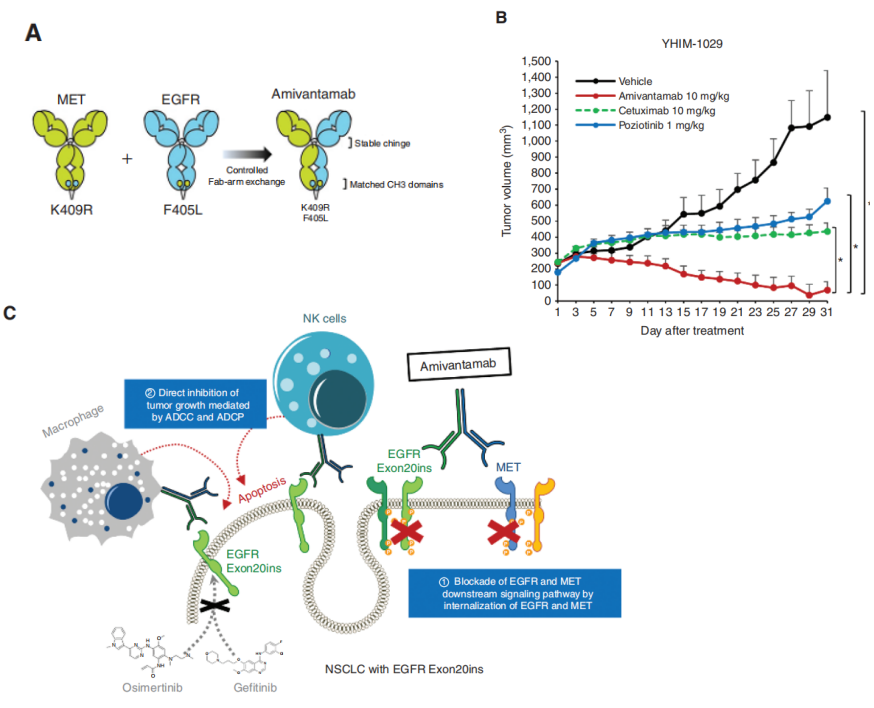
图8:Amivantamab结构和作用机制
康方生物自主研发的PD-1/CTLA-4双特异性抗体卡度尼利单抗于2022年6月29日获批上市,用于治疗接受过含铂化疗治疗失败的复发或转移性宫颈癌患者。成为首个获批上市的国产双抗,也是全球首款PD-1/CTLA-4双抗。其作用机理是阻断PD-1和CTLA-4与其配体PD-L1/PD-L2和B7.1/B7.2的相互作用,从而阻断PD-1和CTLA-4信号通路的免疫抑制反应,促进肿瘤特异性的T细胞免疫活化,进而发挥抗肿瘤作用。卡度尼利单抗的上市为患者提供了新的治疗选择。
相比较单克隆抗体,BsAbs具有单抗所没有的独特理念以及无法比拟的优势,在临床治疗等方面展现出了巨大的前景,目前在研的双抗可以分为T细胞桥接型双抗、双免疫检查点阻断类双抗、免疫检查点阻断+肿瘤微环境调节类双抗、免疫检查点阻断+肿瘤信号通路抑制类双抗、双肿瘤信号通路抑制类双抗、同抗原双表位类双抗、以及促功能复合体形成类双抗等多种类型。如何根据不同的效应机制设计合理的抗体结构也是目前BsAbs研发的重点。未来双抗药物的发展将涉及新靶点、新组合、新平台、新几何构型的开发和应用,以及与传统生物药物、其他形式的免疫治疗、理化治疗的联合治疗。

References
Vafa O, T. ND. Perspective: Designing T-Cell Engagers With Better Therapeutic Windows. Frontiers in oncology (2020).
Labrijn AF, J. ML, R. JM, P. PWHI. Bispecific antibodies: a mechanistic review of the pipeline. Nature reviews. Drug discovery (2019).
Krishnamurthy A, J. A. Bispecific antibodies for cancer therapy: A review. Pharmacology & therapeutics (2018).
Christoph Spiess, et al. Alternative molecular formats and therapeutic applications for bispecific antibodies. Mol Immunoly (2015).
Sedykh, S. E., Prinz, & Nevinsky, G. A. Bispecific antibodies: design, therapy, perspectives. Drug design, development and therapyy (2018).
Kontermann, R. Dual targeting strategies with bispecific antibodies. In MAbs Taylor & Francis. (2012)
Spiess, C., Zhai, Q., & Carter, P. J. Alternative molecular formats and therapeutic applications for bispecific antibodies. Molecular immunology (2015).
Zhang, X., Yang, Y., Fan, D., & Xiong, D. The development of bispecific antibodies and their applications in tumor immune escape. Experimental hematology & oncology (2017).
Jiyeon Yun, Soo-Hwan Lee, &Chul Ch. Antitumor Activity of Amivantamab (JNJ-61186372), an EGFR-MET Bispecific Antibody, in Diverse Models of EGFR Exon 20 Insertion-Driven NSCLC. Cancer Discov (2020).
Yuanyuan Song, Ling Tang, Lin Xia, Xin Tong, Zhimin Yang. Consideration on the Research and Development of Anti-tumor Bispecific Antibody Drugs (2022).
Qiong Wang,Yiqun Chen, &Michael J. Betenbaugh. Design and Production of Bispecific Antibodies.Antibodies (2019).
Rolf Linke, Anke Klein & Diane Seimetz. Catumaxomab. mAbs (2010).
Anuradha Krishnamurthy, Antonio Jimeno. Bispecific antibodies for cancer therapy: A review.Pharmacology and Therapeutics (2017).
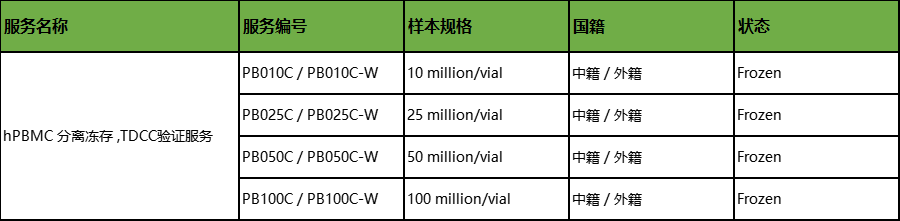
hPBMC分离冻存
TDCC验证服务
由于不同种族、性别、年龄等个体差异的影响,不同供体来源的PBMC细胞TDCC效果有可能会有差异。
妙顺生物TPCS®利用Raji作为靶细胞,PBMC作为免疫效应细胞,倍利妥®(Blincyto®)作为阳性抗体开展TDCC实验,为抗体药物TDCC实验选择合适PBMC提供参考。
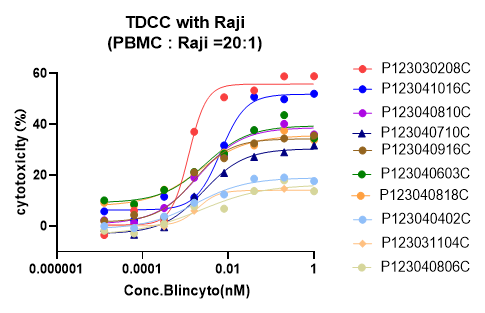
结果显示,倍利妥®(Blincyto®)对Raji细胞有明显的T细胞杀伤效果,并且呈现出剂量依赖性。不同供体来源的PBMC作为效应细胞时,其杀伤作用存在明显差异。





妙顺生物
咨询热线:021-64169739
咨询邮箱:sales@miles-bio.com