2023.12.07
当今社会,随着工作生活节奏的加快,熬夜、焦虑、压力过大及不健康的饮食习惯等带给人们越来越多的肝脏疾病,尤其是非酒精性脂肪肝病(NAFLD),很容易在压力及不良饮食习惯的诱导下出现。如果出现NAFLD而不加控制,则有可能发展为非酒精性脂肪性肝炎(NASH)。一旦发展为NASH,炎症会引起肝损伤。损伤的肝细胞在修复的过程则会导致肝纤维化,甚至肝硬化。而这一过程的终极大boss是肝癌。

图1.健康肝脏到肝癌的组织形态变化
在NASH炎症引起的一系列肝脏病变过程中,肝纤维化是可以在恰当有效的治疗下发生逆转的,而肝星状细胞(Hepatic Stellate Cells, HSCs)的活化是肝纤维化的重要病变机制之一,因此科研人员致力基于 HSCs 研究肝脏损伤的病理过程以及分子机制。
HSCs 是肝脏内具有重要生理和病理功能的一种细胞,呈现梭形、星状或多边形等不规则形态。在正常生理情况下,HSCs处于静息状态,表达胶质纤维酸性蛋白(GFAP)[1,2]和结蛋白(Desmin)[3]。负责维持细胞外基质的稳态和以脂滴形式贮存维生素A。在肝脏受到损伤后,HSCs 会被各种细胞因子激活成肌成纤维细胞样细胞[4,5],进而合成并分泌细胞外基质参与肝损伤修复[6]。肝损伤导致的HSCs的激活、增殖及转化是肝纤维化过程中的重要环节。
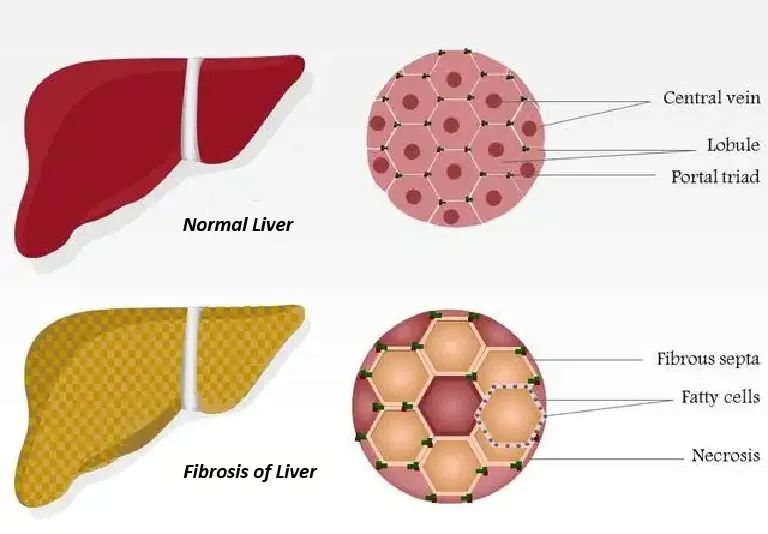
图2.健康肝脏与纤维化肝脏细胞对比
多种细胞因子的刺激都可导致HSCs的活化,包括转化生长因子-β1(TGF-β1)、血小板源性生长因子(PDGF)、血管内皮生长因子(VEGF)和结缔组织生长因子(CTGF)等,这些刺激因子触发HSCs的激活,诱导细胞外基质合成,增加肝细胞凋亡[7]。其中TGF-β1是迄今为止发现的最有效的促纤维化细胞因子[8]。
TGF-β1主要通过3种机制促进肝纤维化的形成:1)TGF-β1通过抑制MMP以及促进TIMP的活性来抑制ECM降解;2)TGF-β1通过上皮细胞间充质转化(EMT)诱导肌成纤维细胞的形成;3)TGF-β1通过Smad通路依赖性和非依赖性相关机制诱导ECM的生成[9]。

图3.肝星状细胞活化机制
有研究表明在静脉注射二氧化硅纳米颗粒诱导损伤的小鼠上,第30天和第60天肝脏中TGF-β1、Smad3和p-Smad3蛋白表达上调(如下图A所示)[10]。TGF-β1对HSC的主要作用是通过上调Notch通路和α-平滑肌肌动蛋白(α-SMA)的表达,刺激静止HSC向活化的肌成纤维细胞转化,使用受体阻断剂LAP阻断TGF-β1与其受体结合,则可以抑制α-SMA的升高(如下图B、C所示)[11]。

图4.(A)二氧化硅纳米颗粒诱导损伤的小鼠30d及60d肝脏中TGF-β1、Smad3/p-Smad3表达量变化。
(B/C)在TGF-β1刺激及LAP阻断作用下,α-SMA蛋白表达量变化。
除了在动物体内诱导肝脏损伤,目前有学者体外培养HSCs,TGF-β1诱导肝纤维化模型来研究验证相关分子通路[12]。
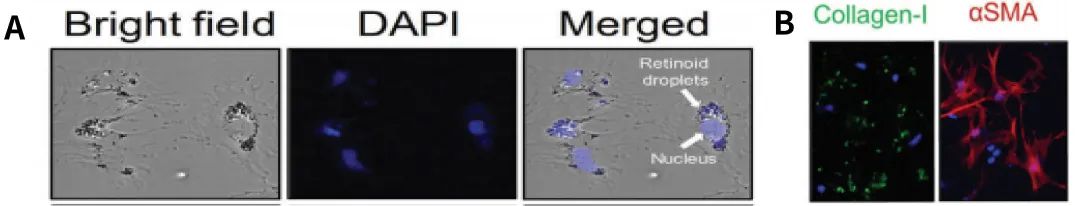
图5.(A)肝星状细胞体外培养。
(B)体外培养肝星状细胞在TGF-β1刺激下Collagen-I和α-SMA荧光鉴定。
支原体、无菌检测阴性,可放心使用
供体动物组织来源清晰合规
冻存复苏细胞活率可达90%,满足实验需求
GFAP与Vimentin免疫荧光鉴定,纯度可达90%


参考文献:
[1]Gard, A.L., White, F.P. and Dutton, G.R. (1985) Extra-neural glial fibrillary acidic protein (GFAP) immunoreactivity in perisinusoidal stellate cells of rat liver. J. Neuroimmunol. 8, 359–375.
[2]Neubauer, K., Knittel, T., Aurisch, S., Fellmer, P. and Ramadori, G. (1996) Glial fibrillary acidic protein-a cell type specific marker for Ito cells in vivo and in vitro. J. Hepatol. 24, 719–730.
[3]Yokoi, Y., Namihisa, T., Kuroda, H. et al. (1984) Immunocytochemical detection of desmin in fat-storing cells (Ito cells). Hepatology 4, 709–714.
[4]Geerts, A., Lazou, J.M., de Bleser, P. and Wisse, E. (1991) Tissue distribution, quantitation and proliferation kinetics of fat-storing cells in carbon tetrachloride–injured rat liver. Hepatology 13, 1193–1202.
[5]Atzori, L., Poli, G. and Perra, A. (2009) Hepatic stellate cell: a star cell in the liver. Int. J. Biochem. Cell Biol. 41, 1639–1642.
[6]Bae, M., Kim, M.-B. and Lee, J.-Y. (2018) The Effect of Astaxanthin and Lutein on the Activation of Hepatic Stellate Cells and the Underlying Mechanisms (E01-01). Curr Dev Nutr 2, nzy030.
[7] Kim KK, Sheppard D, Chapman HA. TGF-β1 Signaling and Tissue Fibrosis. Cold Spring Harb Perspect Biol. 2018 Apr 2;10(4):a022293. doi: 10.1101/cshperspect.a022293. PMID: 28432134; PMCID: PMC5880172.
[8]Navarro-Corcuera A, Ansorena E,Montiel-Duarte C, et al. AGAP2:Modulating TGFβ1-signaling in the regulation of liver fibrosis[J/OL].Int J Mol Sci, 2020, 21.2020-06-09.
[9] Xu F Y, Liu C W, Zhou D D, et al. TGF-β/SMAD pathway and itsregulation in hepatic fibrosis[J]. J Histochem Cytochem, 2016, 64:157-167.
[10] Yu Y, Duan J, Li Y, Li Y, Jing L, Yang M, Wang J, Sun Z. Silica nanoparticles induce liver fibrosis via TGF-β1/Smad3 pathway in ICR mice. Int J Nanomedicine. 2017 Aug 21;12:6045-6057. doi: 10.2147/IJN.S132304. PMID: 28860765; PMCID: PMC5573053.
[11] Liu C, Li J, Xiang X, et al. PDGF receptor-α promotes TGF-βsignaling in hepatic stellate cells via transcriptional andposttranscriptional regulation of TGF-β receptors[J]. Am J PhysiolGastrointest Liver Physiol, 2014, 307(7): G749-G759.
[12] Wu X, Shu L, Zhang Z, Li J, Zong J, Cheong LY, Ye D, Lam KSL, Song E, Wang C, Xu A, Hoo RLC. Adipocyte Fatty Acid Binding Protein Promotes the Onset and Progression of Liver Fibrosis via Mediating the Crosstalk between Liver Sinusoidal Endothelial Cells and Hepatic Stellate Cells. Adv Sci (Weinh). 2021 Jun;8(11):e2003721. doi: 10.1002/advs.202003721. Epub 2021 Mar 27. PMID: 34105268; PMCID: PMC8188197.


妙顺生物
咨询热线:021-64169739
咨询邮箱:sales@miles-bio.com